|
|
|
การระเหิดกลับ
การระเหิดกลับ หรือชื่อภาษาอังกฤษคือ deposition
แต่ในบางประเทศ ยังคงใช้คำว่า sublimation เหมือนเดิม
| Create Date : 29 ธันวาคม 2551 | | |
| Last Update : 29 ธันวาคม 2551 1:55:48 น. |
| Counter : 2305 Pageviews. |
| |
|
 |
|
|
|
โจทย์-เฉลย สมดุลเคมี ต้อนรับปีใหม่

คำถามจากคุณ KZ
ช่วยอธิบายเคมีหน่อยครับ เรื่องการเปลี่ยนความดัน
และอุณหภูมิ กับ ภาวะสมดุลสมมุติ มีระบบสมดุล
อยู //่ระบบ 2NO2 (g) <=> N2O4 แล้วเราทำการลด
ปริมาตรของระบบ ทำให้มีความดันรวมและ ความเข้ม
ข้น Gas มากขึ้น ในหนังสือเขียน(เคมี) ไว้ว่า แก๊สจะ
มีสีเข้มขึ้นแล้วจางลง การที่สีจางลงอธิบายได้ว่า
ความเข้มข้นของ NO2 ลดลง หรือกล่าวได้ว่า NO2
จำนวนหนึ่งรวมตัวกันเกิด N2O4 เพื่อลดความดันรวม
1.ผมถาม ตรงนี้ว่ามันคือการที่ระบบทำปฏิกิริยาไป
ข้างหน้าใช่หรือไม่ (ช่วยอธิบายเพิ่ม)
ตอนที่ 2 เรื่องของ Temp เมื่อนำระบบ ไปเพิ่ม
อุณหภูมิด้วยการแช่น้ำร้อน สีของสารจะเข้มขึ้น
อธิบายไว้ว่า การแยกสลาย gas N2O4 เกิดเป็นgas
NO2 เป็นแบบดูดความร้อน (อ่านอธิบายในหนังสือ
แล้วงงว่า ระบบมันสมดุลอยุ่แล้วการที่เราเพิ่มพลังงาน
จะทำให้ระบบทำปฏิกิริยาไปข้างหน้า? ) < ถูกไหม
ครับ
ถามต่ออีกนิดเพื่อความเข้าใจ
มีระบบ
CO(g) + Cl2(g) <=> COCL2(g)
สมดุลจะเปลี่ยนไปในทิศทางใด
(ผมตอบทุกข้อว่าไปข้างหน้า)
ก. ลด gas CO
ข.เพิ่ม gas คลอรีน
ค.ลด Temp ของระบบ
ง.เพิ่มความดันของระบบ
*ถามอีกข้อครับ ทำๆแล้วสงสัย การกำจัด gas CO
ในท่อไอเสียรถ ทำได้โดยให้ Gas CO ที่เกิดขึ้นทำ
ปฏิกิริยากับ gas O2 บนผิวโลหะบางชนิดที่ Temp
สุง ถามว่า โลหะนั้นคืออะไร แล้ว ที่ Temp ประมาณ
เท่าไหร่ครับ
ถามเยอะไปหน่อยครับ เรียนไม่ค่อยเข้าใจ ^^'
------------------------------------------------------
เฉลย
ข้อนี้ให้พิจารณาโดยใช้หลักของเลอชาเตอลิเย (Le
Chatelier's principle) ครับ คือระบบจะต้านทานการ
เปลี่ยนแปลงที่เราทำกับระบบตลอดเวลา
อย่างในข้อแรกเมื่อมีการลดปริมาตร จะทำให้ความดัน
ของระบบสูงขึ้น ระบบย่อมจะต้านทานการเปลี่ยนแปลง
นี้โดยหาทางทำให้ความดันของระบบลดลง ซึ่งที่ทำได้
คือเปลี่ยนทิศทางของสมการเคมีให้ผลิต N2O4 มากขึ้น
เพราะด้านนั้นของสมการเคมีมีจำนวนโมเลกุลของก๊าซ
น้อยกว่าในกรณีของ NO2 ถึง 2 เท่า ดังนั้นระบบจึงทำ
ปฏิกิริยาไปข้างหน้าถูกต้องแล้วครับ หรือเขียนเป็น
สมการเคมีได้ว่า 2NO2 ---> N2O4
จากการทดลองเพิ่มอุณหภูมิแล้วปรากฏว่า ปฏิกิริยา
เปลี่ยนทิศทางเป็น 2NO2 <--- N2O4 โจทย์ถามว่า
ปฏิกิริยานี้เป็นปฏิกิริยาดูดหรือคายความร้อน
ลองพิจารณาจากกรณีทั่วไปก่อนครับ
2NO2 <---> N2O4 ดูดหรือคายความร้อน?
(เทียบกับสารตั้งต้น NO2)
ให้สมมติเป็นสองกรณี
กรณีแรก ดูดความร้อน หรือ
Heat + 2NO2 <---> N2O4
ถ้ามีการเพิ่มอุณหภูมิ ระบบย่อมหาทางต้านการเพิ่ม
อุณหภูมินั้น ปฏิกิริยาย่อมเป็นในทิศทาง
Heat + 2NO2 ---> N2O4 เพราะมีความร้อนเกิดขึ้น
น้อยกว่า
กรณีสอง คายความร้อน หรือ
2NO2 <---> N2O4 + Heat
ถ้ามีการเพิ่มอุณหภูมิ ระบบย่อมหาทางต้านการเพิ่ม
อุณหภูมินั้น ปฏิกิริยาย่อมเป็นในทิศทาง
2NO2 <---- N2O4 + Heat เพราะมีความร้อนเกิดขึ้น
น้อยกว่า
ดังนั้นปฏิกิริยานี้จึงเป็นปฏิกิริยาคายความร้อนเมื่อเทียบ
กับสารตั้งต้น NO2 นั่นคือ
2NO2 <----> N2O4 + Heat ครับ
แต่ถ้าเทียบกับ N2O4 ปฏิกิริยานี้ดูดความร้อนเพราะ
Heat + N2O4 ----> 2NO2 ที่แบบเรียนกล่าวไว้จึงถูกครับ
เดี๋ยวผมจะมาอธิบายข้อต่อไปครับ ตอนนี้ขอไปทำธุระก่อน
------------------------------------------------------
CO(g) + Cl2(g) <---> COCl2(g)
สมดุลจะเปลี่ยนไปในทิศทางใด ถ้า
ก. ลด gas CO
เมื่อลด gas CO ลง ระบบย่อมต้องต่อต้านการเปลี่ยนแปลงนั้น
โดยการเพิ่มปริมาณของ gas CO ขึ้น ทิศทางของปฏิกิริยาเคมี
จะย้อนกลับดังนี้ครับ (ที่ตอบว่าไปข้างหน้าจึงไม่ถูก)
CO(g) + Cl2(g) <--- COCl2(g)
ข. เพิ่ม gas คลอรีน
เมื่อเพิ่ม gas คลอรีนขึ้น ระบบย่อมต้องต่อต้านการเปลี่ยนแปลงนั้น
โดยการลดปริมาณของ gas Cl2 ลง ทิศทางของปฏิกิริยาเคมี
จะไปข้างหน้าดังนี้ครับ (ที่ตอบว่าไปข้างหน้าจึงถูกแล้ว)
CO(g) + Cl2(g) ---> COCl2(g)
ค. ลด Temp ของระบบ
จะรู้ได้ว่าปฏิกิริยานี้จะเปลี่ยนแปลงอย่างไรเมื่อมีการเพิ่มหรือลดของ
อุณหภูมิเราต้องทราบข้อมูลเพิ่มเติมก่อนว่านี่เป็นปฏิกิริยาดูดหรือคาย
ความร้อน COCl2 รู้จักกันในอีกชื่อคือฟอสจีน (phosgene) หรือ
Muster gas ใช้เป็นก๊าซพิษทำลายล้างฝ่ายศัตรูในช่วงสงครามโลก
ครั้งที่หนึ่ง โดยเหยื่อผู้เคราะห์ร้ายเมื่อสูดเอาฟอสจีนเข้าไป มันจะทำ
ปฏิกิริยากับน้ำได้ CO2 ยับยั้งการแลกเปลี่ยนก๊าซ O2 ของฮีโมโกลบิน
ในเม็ดเลือดแดงของคน และ HCl ย่อยสลายถุงลมในปอด จึงมีความ
เป็นพิษสูงมาก
ปฏิกิริยาดังกล่าวเป็นปฏิกิริยาคายความร้อน หรือ
CO(g) + Cl2(g) <---> COCl2(g) + Heat
ดังนั้นถ้าลดอุณหภูมิของระบบลง ระบบก็จะต้านทานการเปลี่ยนแปลงนี้
โดยเพิ่มอุณหภูมิของระบบขึ้น โดยมีทิศทางของปฏิกิริยาเคมีไปข้างหน้า
CO(g) + Cl2(g) ---> COCl2(g) + Heat
(ที่ตอบว่าไปข้างหน้าจึงถูก)
ง. เพิ่มความดันของระบบ
เมื่อความดันของระบบเพิ่มสูงขึ้น ระบบย่อมต้านทานการเปลี่ยนแปลง
ความดันนี้โดยจะลดความดันลง ซึ่งทำได้โดยเปลี่ยนทิศทางของ
ปฏิกิริยาไปยังด้านที่มีจำนวนโมเลกุลของก๊าซน้อยกว่า นั่นก็คือ
CO(g) + Cl2(g) ---> COCl2(g) นั่นเอง (ที่ตอบว่าไปข้างหน้าจึงถูก)
ความรู้เพิ่มเติมเกี่ยวกับฟอสจีน
//www.nationmaster.com/encyclopedia/Phosgene
------------------------------------------------------
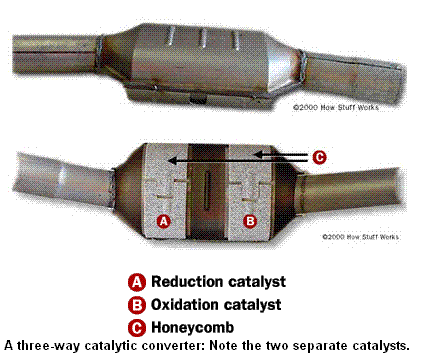
ตัวอย่างของโลหะดังกล่าวได้แก่ platinum,
rhodium and/or palladium ส่วนของเครื่องยนต์ที่
ทำหน้าที่ขจัดไอเสียนี้มีชื่อว่า catalytic converter
ซึ่งแบ่งได้เป็นสามส่วนตามภาพด้านล่างครับ ราย
ละเอียดเพิ่มเติมสามารถหาอ่านได้ตามแบบเรียน
ทั่วไป
ตัวอย่างแหล่งข้อมูล
//auto.howstuffworks.com/catalytic-converter2.htm

| Create Date : 01 มกราคม 2548 | | |
| Last Update : 9 มกราคม 2548 9:30:38 น. |
| Counter : 4029 Pageviews. |
| |
|
| |
|
|
|
|
|
|